Abstract
Introduction: Myocardial ischemia is often asymptomatic and remains a first cause of morbidity and mortality in diabetic’s patients. This study aimed to determine the prevalence of Silent Myocardial Ischemia (SMI) among diabetics.
Methods: It was a cross sectional and analytic study with prospective data collection from April to August 2014. We included all consent diabetes aged 18 years and over. All patients with clinical and/or electrocardiographic abnormalities suggestive of coronaropathy or those with sub maximal stress test were not included. SMI was retained when the stress test was positive according to SFC/ALFEDIAM de 2004 guidelines.
Results: The stress test has been done for 108 diabetics. The mean age was 50,2±11,2 years and the sex-ratio 1,6. The diabetes was type 2 in 91,5% and controlled in 66%. These patients have another cardiovascular risk factors in 87,8%. At rest, the electrocardiogram was not normal in 54,9%. After stress test 11% of diabetics were diagnosed for SMI. The history of stroke is the only one factor associated with SMI.
Conclusion: These data show that SMI was frequent among diabetic in Parakou independently of diabetes’ age and the resting electrocardiogram result. SMI screening is necessary to improve the management of diabetes in this city.
Keywords
screening; silent myocardial ischemia; diabetic complications; stress test; Africa
Introduction
Le diabète, associée ou non à d’autres facteurs de risque cardiovasculaires, est une véritable menace de santé publique [1]. En effet, les complications cardiovasculaires, principalement l’atteinte coronarienne, représentent la première cause de morbidité et de mortalité chez les sujets diabétiques [2,3]. Plus de 75 % des diabétiques décèdent d’accidents cardiovasculaires, au premier rang desquels l’insuffisance coronarienne responsable de 50 % des décès [4]. Malheureusement, du fait de l’existence de la neuropathie autonome cardiaque qui lui est associée, l’insuffisance coronarienne se présente souvent sous forme silencieuse chez les diabétiques. Elle doit être recherchée, quelle que soit la durée d’évolution du diabète afin de réduire la morbi-mortalité cardiovasculaire [5]. Le dépistage de l’ischémie myocardique silencieuse (IMS), bien que controversé, contribue à l’optimisation du traitement du diabétique [6, 7]. Il est donc indispensable chez le diabétique et fait appel à différentes techniques, dont l’épreuve d’effort (EE) [7]. Elle est proposée en première intention et éviterait le recours abusif aux moyens invasifs d’explorations [8]. Nous rapportons ici les résultats d’un dépistage systématique de l’IMS chez les diabétiques suivis en milieu hospitalier à Parakou en 2014.
MATERIEL ET METHODES
Cadre et nature de l’étude
L’étude s’est déroulée dans le service de diabétologie du Centre Hospitalier Universitaire Départemental du Borgou (CHUD-B) et dans le service de cardiologie de l’Hôpital d’Instruction des Armées (HIA-Pk) de la ville de Parakou. Il s’était agi d’une étude transversale descriptive et analytique avec un recueil prospectif des données, sur la période du 1er Avril au 31 Août 2014.
Population d’étude
Notre population d’étude était représentée par l’ensemble des patients reçus en consultation pendant la période d’étude. Étaient inclus, tous les patients diabétiques âgés d’au moins 18ans, n’ayant aucun signe d’appel d’insuffisance coronarienne (douleur thoracique, dyspnée) et ayant donné leur consentement à la réalisation de l’étude. Nous avions exclus les patients qui avaient une épreuve d’effort sous maximale négative. Le recrutement des patients était systématique.
Variables et technique de collecte
La variable dépendante était la fréquence de l’IMS, et les variables indépendantes étaient représentées par les caractéristiques socio démographiques, les données de l’électrocardiogramme de repos, les facteurs de risque cardiovasculaire notamment, le diabète, l’hypertension artérielle, l’obésité, la dyslipidémie, la sédentarité, et les caractéristiques du diabète notamment son ancienneté, son équilibre, ses complications dégénératives.
La technique de collecte était une entrevue individuelle et l’outil utilisé était une fiche d’enquête prétestée sur laquelle ont été recueillies les données clinique et paraclinique. L’entrevue a été menée à l’unité de diabète, puis les patients ont été revus à l’HIA-Pk pour la réalisation de l’épreuve d’effort. L’épreuve d’effort était démaquillée. En effet les dérivés nitrés, les antagonistes calciques de brèves durées d’action, bétabloquants et tout autre vasodilatateur ont été suspendus 48 heures avant le jour de l’examen. Le test d’effort a été réalisé sur un cyclo-ergomètre et a consisté en une augmentation de la puissance par palier de 25 watts (W) toutes les trois minutes. L’épreuve d’effort a été dite maximale lorsque la fréquence cardiaque du sujet à l’effort atteignait au moins 85% de la fréquence maximale théorique (220-âge) [9]. L’IMS a été définie par les critères suivant [7] :
- absence de symptômes évocateurs d’ischémie myocardique (dyspnée, douleur thoracique)
- absence d’anomalie de la repolarisation ni d’ondes Q de nécrose à l’ECG de repos
- épreuve d’effort maximale positive (sous décalage du segment ST de 2mm sur 80ms après le point J et/ou une inversion de l’axe des ondes T ou douleur thoracique angineuse ou instabilité hémodynamique ou rythmique)
L’hypertension artérielle (HTA) a été retenue devant toute tension artérielle supérieure ou égale à 140mmHg pour la systolique et /ou 90mmhg pour la diastolique, ou une tension artérielle normale sous traitement antihypertenseur. A été considéré comme tabagique, tout patient qui a consommé au moins une fois tout produit de tabac. Ce tabagisme était dit ancien lorsque la dernière consommation remontait à plus de trois ans.
L’alcoolisme était abusif, lorsque la consommation quotidienne d’alcool supérieure à l’équivalent de 20g d’alcool par jour pour la femme et 30g pour l’homme. L’excès pondéral, a été défini par un indice de masse corporelle (IMC)≥25kg/m². Les recommandations de l’IDF 2005 chez les africains subsahariens avaient été utilisées pour définir l’obésité abdominale. Il s’agissait d’un tour de taille supérieur ou égal à 94cm chez l’homme et 80cm chez la femme [10]. Etait sédentaire, tout patient qui faisait moins de 30 minutes d’activité physique 3 fois par semaine et/ou reste plus de 8 à 12 heures en position assise ou couchée chaque jour. L’artériopathie chronique oblitérante des membres inférieurs a été recherchée à l’aide du questionnaire d’Edimbourg [11]. L’Accident vasculaire cérébral a été évoqué devant la notion d›un déficit neurologique focal d’installation brutale. Etaient considérés comme ayant une neuropathie, les patients ayant un score DN4 (douleur neuropathique en quatre questions) d’au moins 4/10 [12]. La néphropathie retenue devant la présence de protéinurie à la bandelette urinaire. La rétinopathie a été diagnostiquée au fond d’oeil et classée en quatre stades par un ophtalmologue.
Les données ont été analysées par le logiciel Epi info 3.5.1. Les graphiques et tableaux ont été confectionnés avec Microsoft Excel 2007. Les comparaisons de fréquences ont été effectuées à l’aide du test Chi carré de Pearson ou de Fisher selon le cas. Le seuil de significativité était de 5%.
Sur le plan éthique, les patients ayant une IMS dépistée ont été pris en charge par un cardiologue. L’accord du comité local d’éthique a été obtenu et la confidentialité des données recueillies a été respectée.
RESULTATS
Au total, 108 patients diabétiques ont été inclus durant la période d’étude. Nous en avons exclus quatre pour épreuve d’effort sous-maximale négative. Notre étude a finalement porté sur 104 diabétiques.
Caractéristiques du diabète
La moyenne d’âge des patients était de 50,2±11,2 ans, avec des extrêmes de 22 ans et 72 ans. La sex-ratio était de1,6. Le diabète était de type 2 chez 91,5%. L’ancienneté moyenne du diabète était de 6,6 ± 5,9 ans (4mois à 9 ans). La glycémie a varié de 0,83 à 4,4 g/l avec une moyenne de 1,6 ± 0,7g/L. Le diabète était contrôlé dans 65,9% des cas. Les autres facteurs de risque cardiovasculaire cumulés par les diabétiques étaient principalement l’obésité (88%) et l’l’HTA (61%). Le profil lipidique n’a pu être exploré chez les diabétiques pour inaccessibilité technique. Dans 87,8% des cas, les patients avaient au moins un facteur de risque associé au diabète. Les complications du diabète étaient dominées par la rétinopathie (66,7%) et les neuropathies périphériques (53,7%). Le tableau I présente la prévalence de chaque facteur, le nombre de facteurs cumulés par les patients et les complications dégénératives.
Tableau I : Prévalence des facteurs de risque cardiovasculaire et des complications chez les diabétiques suivis à Parakou en 2014
| Effectif | Pourcentage | |
| Facteurs de risque cardiovasculaire cumulés
Hypertension Artérielle Tabagisme Obésité Sédentarité Excès d’alcool |
63 9 91 19 19 |
61 8,5 88 18,3 18,3 |
| Nombre de facteur de risque cardiovasculaire cumulés
0 1 et 2 3 et plus |
13 64 27 |
12,5 61,5 26 |
| Complications dégénératives
Rétinopathie diabétique* Neuropathie périphérique Artériopathie symptomatique Néphropathie Accident Vasculaire Cérébral |
29 56 99 16 2 |
66,7 53,7 19,5 15,9 1,9 |
* n=43
Etude de l’électrocardiogramme et prévalence de l’IMS (tableau II)
Tableau II : Caractéristiques électrocardiographiques et prévalence de l’ischémie myocardique silencieuse chez les diabétiques suivis à Parakou en 2014
| Fréquence | Prévalence | |
| Au repos
ECG normal Surcharge atriale gauche Surcharge ventriculaire gauche Extrasystoles Altération diffuse de la repolarisation Déviation axiale gauche |
47 28 29 4 9 11 |
45,1 26,8 28 3,6 8,6 11 |
| A l’effort
Test positif Test négatif |
11 93 |
11 89 |
Au repos, la fréquence cardiaque moyenne était de 82,6±13,5 bpm, avec des extrêmes de 56 et 112 bpm. L’électrocardiogramme (ECG) était anormal chez 57 sujets (54,8%). La surcharge ventriculaire gauche et celle auriculaire gauche étaient les anomalies prédominantes.
A l’effort, la charge moyenne assurée était de 195 ±53,5 Watts avec des extrêmes de 75 et 325 Watts. L’épreuve d’effort était positive chez 11 patients soit une prévalence de 11%. La figure 1 montre en iconographie un sous décalage horizontal du segment ST de 2,7mm en V5, observé chez un patient de 64ans ayant mené une épreuve d’effort maximale avec une charge de 200W.
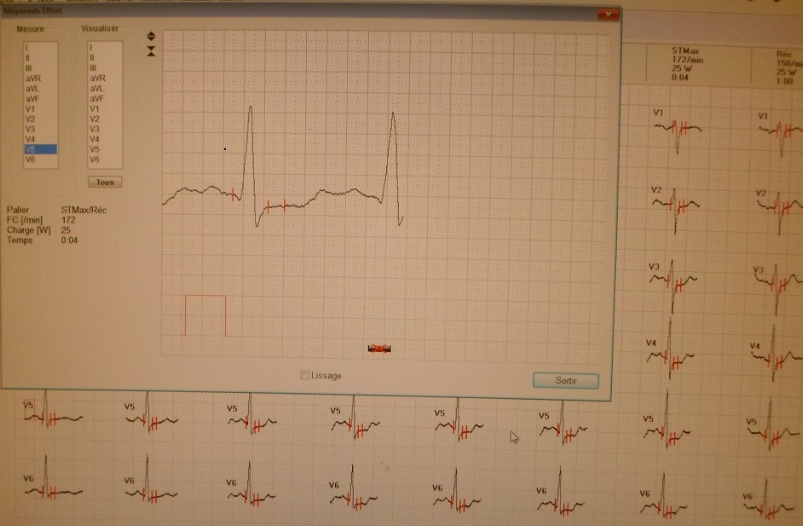
Figure n°1: Dépistage de l’ischémie myocardique silencieuse chez les diabétiques suivis è Parakou en 2014 : Sous décalage du segment ST à l’effort chez un sujet de 64ans.
Facteurs associés à l’IMS (tableau III)
Il n’y avait pas de relation statistiquement significative entre l’IMS et l’âge, l’ancienneté du diabète, la glycémie à jeun, l’HbA1c, la fréquence cardiaque de repos, le nombre de facteurs de risque cumulés, la tension artérielle. Parmi les complications athéromateuses, seul l’accident vasculaire cérébral était statistiquement associé à l’IMS. Les anomalies de l’ECG de repos n’étaient pas associées à l’existence d’une IMS.
Tableau III : Facteurs associés à l’ischémie myocardique silencieuse (IMS) chez les diabétiques suivis à Parakou en 2014
| IMS présente | IMS absente | p | |
| Facteurs de risque cardiovasculaire
Age moyen (années) Sex-ratio IMC (kg/m²) Tour de taille (cm) Hypertension artérielle (%) Tabac (%)
|
54,2 ±10 0,8 30,3 ± 19,2 91,7 ± 10,7 55,6 0
|
49,7 ±11,2 1,7 27,8 ± 8,9 95,2 ± 12,8 61,6 9,6
|
0,257 0,301 0,506 0,537 0,724 1
|
| Caractéristiques du diabète
Ancienneté moyenne (années) Taux moyen d’hémoglobine glyquée (%) Nombre moyen de facteur de risque cardiovasculaire cumulés |
6,4 ±3,7 6,8 ±1
1,7 ± 0,9 |
6,6 ±3,1 6,9 ±1,2
1,9 ± 1,2 |
0,926 0,864
0,647 |
| Complications dégénératives (%)
Rétinopathie diabétique Neuropathie périphérique Artériopathie symptomatique Néphropathie Accident Vasculaire Cérébral |
10 44 22 0 11 |
9 54,8 19,2 17,8 0 |
0,372 0,726 1 0,341 0,004 |
| Caractéristiques de l’électrocardiogramme de repos
Fréquence cardiaque moyenne (bpm) Anormal (%) |
79,3 ±9,6 77,8 |
82,9 ±13,9 52,1 |
0,449 0,143 |
Discussion
L’objectif de cette étude était de déterminer la prévalence de l’IMS au sein des patients diabétiques suivis en milieu hospitalier à Parakou. Pour ce faire un dépistage par test d’épreuve d’effort a été fait systématiquement chez chaque patient. Ce dépistage systématique n’est pas rentable en termes de rapport coût/efficacité et une approche basée sur l’évaluation préalable du risque cardiovasculaire global a été proposée par l’ALFEDIAM depuis 2004 [7]. Le plateau technique disponible à Parakou, au moment de l’étude, ne permettait pas cette évaluation risque de façon précise. En effet, il n’était pas possible d’avoir le profil lipidique des patients ni un dépistage précis de l’artériopathie oblitérante des membres pelviens avec un doppler. En sachant que la plupart des patients vus à l’hôpital dans notre pays ont déjà une complication dégénérative [13], il nous a paru plus logique d’évaluer tous les diabétiques à la recherche de l’IMS. L’épreuve d’effort est l’examen de première intention recommandée pour le dépistage de l’IMS même si sa sensibilité, sa spécificité et sa valeur prédictive négative sont faibles [14].
L’IMS est fréquemment observée chez le diabétique et sa prévalence varie entre 10 et 30% selon le niveau de risque cardiovasculaire des patients et le test de dépistage utilisé [15]. Dans notre étude, elle était de 11%. Elle est similaire à celle retrouvée dans une étude Milanaise en 1997 où l’IMS a été dépistée dans 12,1 % des cas par l’épreuve d’effort [16]. D’autres études ont trouvé des fréquences plus élevées à partir de l’épreuve d’effort. Janand-Delenne et al en 1999 en France (15,7%) [17], Sahli et al en Tunisie en 2012 (21%) [18], Sadoudi et al en 2014 en Algérie (29%) [19]. Houénassi et al, ont trouvé à Cotonou en 2005, un taux d’ischémie silencieuse de 21,4% à partir d’une association de méthodes diagnostiques (EE et échodoppler cardiaque) [20]. Cette forte proportion d’IMS rapportée par ces différents auteurs, pourrait s’expliquer d’une part, par certaines caractéristiques du diabète, notamment, la grande ancienneté et le mauvais équilibre. En effet, Janand-Delenne et al, Sadoudi et al ont rapporté respectivement une ancienneté de 16,5±7,1 ans et 14,2±7,6 ans, contre 6,6±5,9 ans dans notre étude. Aussi, Sahli et al, ont constaté un mauvais équilibre du diabète dans leur étude (HbA1c moyenne 8,08± 1,9 % contre 6,8 ±1% dans notre étude). D’autre part, l’inclusion des patients ayant un ECG de repos ischémique par Houénassi et al, pourrait expliquer la forte fréquence d’IMS notée dans leur étude. La fréquence de l’IMS dans notre étude aurait été encore plus basse, si d’autres méthodes diagnostiques plus approfondies avaient été utilisées. En effet, dans l’étude Milanaise, on note une baisse de la fréquence de l’IMS à 6,4 %, lorsqu’une réponse positive à deux tests était exigée (EE et scintigraphie couplée à l’effort). Le même constat a été fait dans l’étude de Sadoudi et al où la fréquence d’IMS est passée de 29% à partir de l’épreuve d’effort à 13% à la coronarographie. Aussi, Araz et al [21] ont trouvé une fréquence de 15,5% à la scintigraphie myocardique de stress. Cette fréquence est passée à 9,6% à la coronarographie. Gokcel et al, [22] ont trouvé une fréquence de 8,9% à la scintigraphie myocardique. Cette fréquence est passée à 7,6% à la coronarographie. L’épreuve d’effort présente des limites devant d’autres méthodes diagnostiques de l’IMS telles que la scintigraphie myocardique et la coronarographie. Il ressort de tout ce qui précède que la prévalence de l’IMS est plus faible dans notre série où la majorité des patients ont un risque cardiovasculaire plutôt élevé. Ceci est probablement en rapport avec la faible prévalence d’atteinte coronarienne qui contraste avec le fort taux de complications cérébrovasculaire observé chez le noir afro caraibéen [23, 24].
Dans notre étude, l’âge n’était pas associé à l’existence de l’IMS. Pourtant dans la littérature, l’âge supérieur à 60 ans est associé à une prévalence élevée d’IMS chez les diabétiques [20,25,26]. La petite taille de notre échantillon pourrait expliquer cette absence d’association. De même, ni l’ancienneté du diabète, ni son équilibre n’était associé à la survenue d’IMS dans notre série. Sadoudi et al, Araz et al avaient observé des relations significatives. Selon les travaux de Sahli et al, le taux moyen de l’HbA1c était significativement plus élevé chez les diabétiques ayant une IMS que ceux sans IMS [18]. Le mauvais équilibre glycémique a un effet délétère sur le risque artériel chez les diabétiques (macroangiopathie), bien qu’il apparait comme un facteur de risque plus puissant pour la survenue des complications micro-vasculaires. Seul l’antécédent personnel d’accident vasculaire cérébral est apparu comme la complication du diabète associée à l’IMS dans notre étude. D’autres travaux ont plutôt retrouvé l’AOMI, [17,27, 28], la rétinopathie [17,28] et la néphropathie [19]. L’IMS est presque toujours associée à d’autres complications du diabète ; d’où la nécessité de son dépistage chez les patients diabétiques. Nous n’avons pas trouvé d’association significative dans notre étude entre l’IMS et les facteurs de risque. D’autres études comme nous, ont également fait ce même constat [17,27, 28]. Néanmoins dans l’étude de Gokcel et al [22], l’hypertension artérielle, est apparue comme le seul facteur de risque lié à l’IMS. Le diabète à lui seul constitue un haut risque de maladies cardio vasculaires.
A l’issue de notre étude, l’état de l’ECG de repos normal n’était pas associé à l’absence d’IMS. Ceci est contraire aux résultats de Mbaya et al qui rapporte que l’existence d’une dilation de l’oreillette gauche et d’une hypertrophie ventriculaire gauche chez le diabétique à haut risque cardiovasculaire, pourrait témoigner d’une IMS [29].
Conclusion
Au terme de notre étude, il ressort que les diabétiques suivis en milieu hospitalier à Parakou ont souvent d’autres facteurs de risque cardiovasculaire associés et des complications dégénératives asymptomatiques. L’ischémie myocardique silencieuse (IMS) est présente dans cette population de diabétique et est associée aux autres complications dégénératives sans relation avec relation avec l’ECG de repos. L’épreuve d’effort à la recherche de l’IMS devrait faire partie du bilan systématique de nos patients diabétiques africains.
Conflit d’interet: Néant
Contribution Des Auteurs
- Conception de la recherche et supervision: HOUENASSI DM
- Collecte des données et rédaction de l’article: CODJO HL, OGOUYEMI WP
- Revue de littérature et relecture du manuscrit: ADJAGBA P, DOHOU SHM, SONOU DA, HOUNPONOU M, ALASSANI A, WANVOEGBE A
References
- Jaussaud J, Douard H, Catargi B. Dépistage de l’ischémie myocardique silencieuse chez le diabétique. Revues Générales 2013; 294: 11-6.
- Hammoud T, Tanguay JF, Bourassa MG (2000) Management of coronary artery disease: therapeutic options in patients with diabetes. J Am Coll Cardiol 36: 355-365. [crossref]
- ANAES (1999) Recommandations pour la pratique clinique, suivi du patient diabétique de type 2 à l’exclusion de suivi des complications. c1999.
- Kusnik–Joinville O, Weill A, Ricordeau P, Allemand H (2008) Diabète traité en France en 2007: un taux de prévalence proche de 4% et des disparités géographiques croissantes. Bulletin épidémiologique hebdomadaire 43: 409.
- Mankai A, Abid N, Bouzid K, Othmen R, Ibrahim H, Janhani N (2013) Dépistage de l’ischémie myocardique silencieuse chez des diabétiques de type 2. Diabetes & Metabolism S1: A74
- Young LH, Wackers FJ, Chyun DA, Davey JA, Barrett EJ, Taillefer R, et al. Cardiac outcomes after screening for asymptomatic coronary artery disease in patients with type 2 diabetes. The DIAD study : a randomized controlled trial. JAMA 301:1547-1555
- Puel J, Valensi P, Vanzetto G, Lassmann-Vague V, Monin JL, et al. (2004) [Identifying myocardial ischaemia in diabetics. SFC/ALFEDIAM joint recommendations]. Arch Mal Coeur Vaiss 97: 338-357. [crossref]
- Paries J, Brulport-Cérisier V, Valensy P (2005) Predictive value of silent myocardial ischemia for cardiac events in diabetic patients.influence of age in a french multicenter study. Diabetes Care 29: 2722-7.
- [No authors listed] (1997) [Guidelines of the French Society of Cardiology for exercise testing of adults in cardiology]. Arch Mal Coeur Vaiss 90: 77-91. [crossref]
- The IDF consensus worldwide definition of metabolic syndrome. IDF2005. http://www.idf.org/webdata/docs/Diabetes_meta_syndrome.pdf
- Aboyans V, Lacroix P, Waruingi W, Bertin F, Pesteil F (2000) Traduction française et validation du questionnaire d’Edimbourg pour le dépistage de la claudication intermittente. Arch Mal Coeur et des Vaiss 93: 1173-7.
- Bouhassira D1, Attal N, Alchaar H, Boureau F, Brochet B, et al. (2005) Comparison of pain syndromes associated with nervous or somatic lesions and development of a new neuropathic pain diagnostic questionnaire (DN4). Pain 114: 29-36. [crossref]
- Houénassi DM, Tchabi Y, Awanou B, Véhounkpé-Sacca J, Yovo RAD, et al. (2013)Évolution du risque cardiovasculaire des patients traités pour HTA à l’hôpital d’instruction des armées de Cotonou. Ann Cardiol Angeiol 62 :12-6.
- Rubler S, Gerber D, Reitano J, Chokshi V, Fisher V (1987) Predictive value of clinical and exercise variable for detection of coronary artery disease inmen with diabetes mellitus. Am J Cardiol 59: 1310-3.
- Langer A, Freeman MR, Josse RG, Steiner G, Armstrong PW (1991) Detection of silent myocardial ischemia in diabetes mellitus. Am J Cardiol 67: 1073-1078. [crossref]
- Milan study on atherosclerosis and diabetes (MiSAD) group. Prevalence of unrecognized silent myocardial ischemia and its association with atherosclerotic risks factors in noninsulin-dependent diabetes mellitus. Am J Cardiol 79 : 134-9.
- Janand-Delenne B1, Savin B, Habib G, Bory M, Vague P, et al. (1999) Silent myocardial ischemia in patients with diabetes: who to screen. Diabetes Care 22: 1396-1400. [crossref]
- Sahli N, Temessek A, Tertek H, Antit M, Khadraoui E, Trabelsi N (2012) L’équilibre glycémique du diabète de type 2 et l’ischémie myocardique silencieuse. Diabetes & Metabolism 38: A116.
- Sadoudi Y, Merad B (2014) Apport de l’épreuve d’effort dans le dépistage de l’ischémie myocardique silencieuse chez les femmes diabétiques. Diabetes & Metabolism 40: A34
- Houénassi M, Amoussou-guénou D, Tchabi Y, Djrolo F, Sacca-Véhounkpé J, et al. (2007) Dépistage de l’insuffisance coronaire du diabétique au CNHU de cotonou. Bénin Médical 35: 25-9.
- Araz M, Celen Z, Akdemir I, Okan V (2004) Frequency of silent myocardial ischemia in type 2 diabetic patients and the relation with poor glycemic control. Acta Diabetol 41: 38-43. [crossref]
- Gokcel A, Aydin M, Yalcin F, Yapar AF, Ertorer ME, et al. (2003) Silent coronary artery disease in patients with type 2 diabetes mellitus. Acta Diabetol 40: 176-180. [crossref]
- Lip GY, Barnett AH, Bradbury A, Cappuccio FP, Gill PS, et al. (2007) Ethnicity and cardiovascular disease prevention in the United Kingdom: a practical approach to management. J Hum Hypertens 21: 183-211. [crossref]
- McGruder HF, Malarcher AM, Antoine TL, Greenlund KJ, Croft JB (2004) Racial and ethnic disparities in cardiovascular risk factors among stroke survivors: United States 1999 to 2001. Stroke 35:1557–61.
- Varenne O (2008) Comment détecter la maladie coronaire athéromateuse chez les patients diabétiques de type 2. Arch of cardiovascular Disease 101: 30-35.
- Booth G, Kapral M, Fung K (2006) Relation betwen age and cardiovascular disease in men and women with diabetes compared with non-diabetic people: a population based retrospective cohort study. Lancet 368: 29-36.
- Le Feuvre C, Barthélemy O, Dubois-Laforgue D, Maunoury C, Mogenet A (2005) Stress myocardial scintigraphy and dobutamine echocardiography in the detection of coronary disease in asymptomatic patients with type 2 diabetes. Diabetes & Metabolism 2: 135-42.
- Naka M, Hiramatsu K, Aizawa T, Momose A, Yoshizawa K (1992) Silent myocardial ischemia in patients with non-insulin-dependent diabetes mellitus as judged by treadmill exercise testing and coronary angiography. Am Heart J 123: 46–53.
- Mbaye A, Yaméogo NV, Ndiaye MB, Kane AD, Diack B, et al. (2011) [Screening of silent myocardial ischaemia by dobutamine stress echocardiography among type 2 diabetics at high cardiovascular risk in Senegal]. Ann Cardiol Angeiol (Paris) 60: 67-70. [crossref]